近日,北京大学深圳研究生院/省部共建肿瘤化学基因组学国家重点实验室黄昊课题组与深圳市第三人民医院/国家感染性疾病临床医学研究中心张国良课题组合作,在国际学术期刊Nature Communications发表了题为“The Complex Structure of GRL0617 and SARS-CoV-2PLpro Reveals a Hotspot For Antiviral Drug Discovery”的研究论文。该研究利用结构生物学和细胞生物学手段,发现小分子抑制剂GRL0617可以抑制新冠病毒的木瓜样蛋白酶(PLpro)体外剪切泛素链和类泛素化蛋白ISG15链的活性,以及抑制病毒复制的能力,并通过抑制剂与蛋白复合物结构和二维NMR实验揭示GRL0617干扰PLpro与ISG15的蛋白-蛋白相互作用(Protein-ProteinInteraction,PPI),是一种PPI抑制剂。文章在细胞水平和原子分辨率的晶体结构水平确认了新冠病毒蛋白酶PLpro是抗病毒药物开发的靶点,并利用多种生物物理学手段发现小分子抑制剂GRL0617的结合位点即是靶向PLpro抗病毒药物开发的高效位点(Hot spot)。
SARS-CoV-2是导致COVID-19大流行的病原体,迄今为止尚无特效抗病毒药物。而PLpro在病毒成熟,干扰宿主炎症反应和抗病毒免疫反应中起重要作用,PLpro的多种功能使其成为潜在的药物靶标,为了寻找PLpro的抑制剂,作者筛选了FDA药物库,和一些已经报道对SARS病毒PLpro具有良好抑制活性的化合物。发现SARS病毒PLpro的抑制剂GRL0617在体外表现出2.1μM的抑制活性,并且在Vero E6细胞的抗病毒实验中表现出了较好的抑制效果。
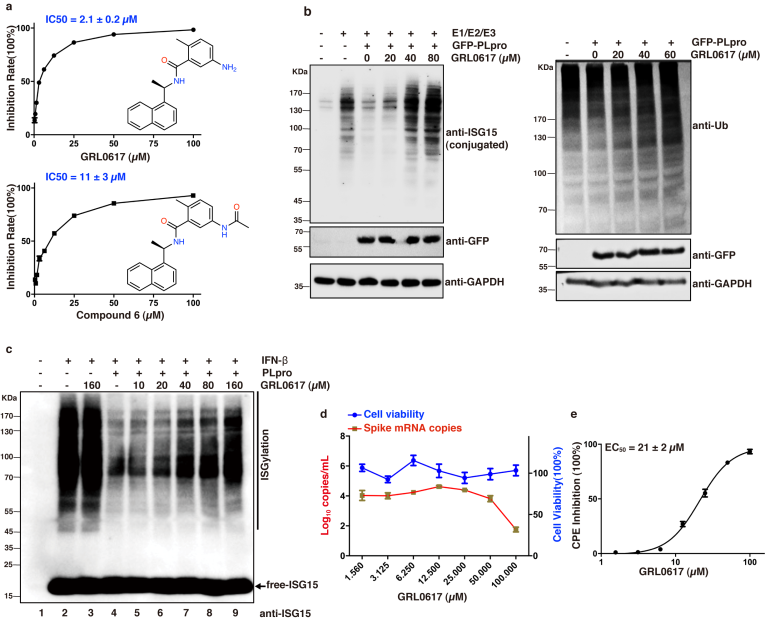
Fig1GRL0617具有体外抑制PLpro活性及在VERO E6细胞中抑制病毒复制的能力
为了验证化合物GRL0617的作用机制,作者解析了SARS-CoV-2 PLpro与GRL0617的共晶体结构,抑制剂GRL0617位于PLpro的USP结构域中,并且化合物的结合导致了两个关键氨基酸Y268和Q269的翻转,促进了有效的结合。
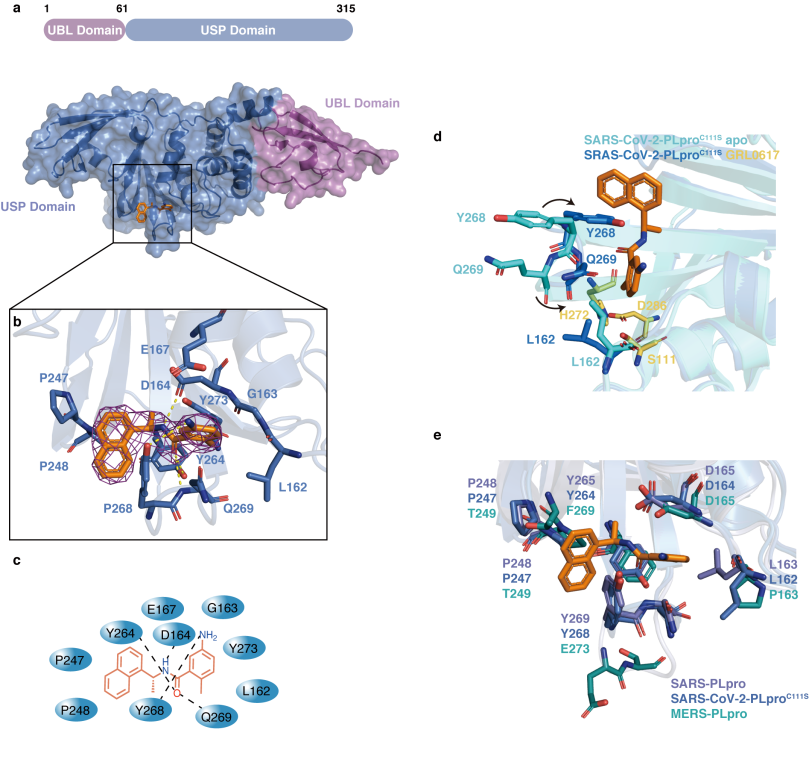
Fig2GRL0617与PLpro结合位点信息
随后,通过二维NMR实验揭示GRL0617阻断了ISG15 C末端与PLpro的结合。
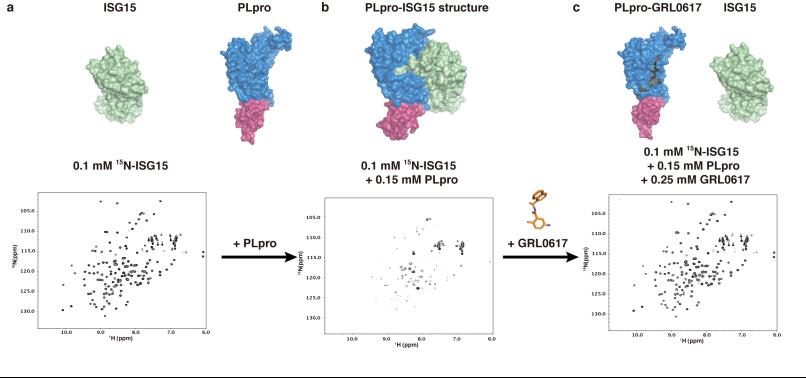
Fig3NMR结果揭示GRL0617破坏ISG15与PLpro的相互作用
因为GRL0617可以几乎完全阻断PLpro与ISG15的相互作用,而GRL0617的结合位点与ISG15的C末端重合,作者提出ISG15的C末端在与PLpro结合中起到主导作用(dominanteffect)。作者获得了ISG15的截短突变体,并且利用NMR和ITC发现ISG15的截短突变体与PLpro几乎没有相互作用,证明了ISG15的C末端在两个蛋白结合时的主导作用。这样,ISG15的C末端尾部结合位点是PPI抑制剂开发的热点口袋。
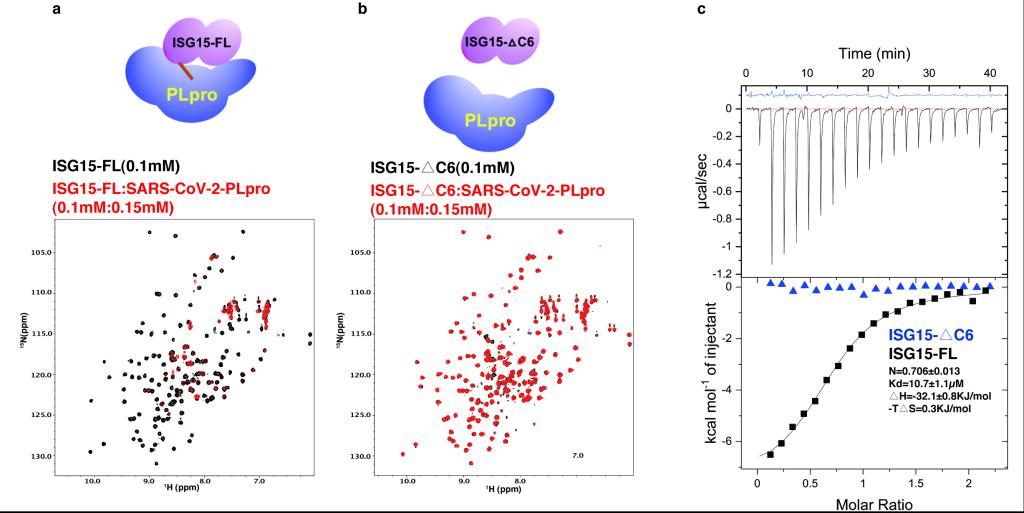
Fig 4ISG15 C端尾巴在与PLpro结合中扮演决定性角色
作者进一步比较了几种人源去泛素化酶(DUB)USP7和USP14和抑制剂的共晶结构与PLpro/GRL0617的复合物结构发现,USP7/14的若干非共价抑制剂也是结合在该结合口袋,该项研究指出针对该口袋的抗病毒药物开发未来可能是治疗COVID-19的有效方法。
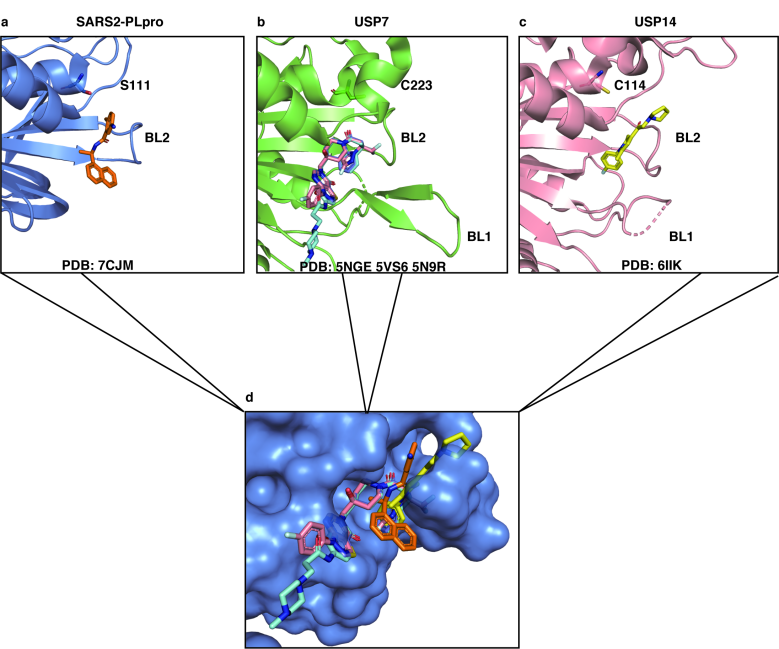
Fig 5多种已报道去泛素化酶抑制剂与GRL0617结合在相似口袋中
北京大学博士研究生付子阳,博士后黄斌、汤金乐和深圳第三人民医院的刘淑燕博士为该论文的并列第一作者,北京大学深圳研究生院黄昊研究员和深圳市第三人民医院的张国良教授为该论文的共同通讯作者。该研究得到了国家自然科学基金、广东省自然科学基金、深圳市科创基金及深圳湾实验室开放基金的支持。北京大学北京核磁共振中心的牛晓刚博士和上海光源的周欢博士对本文提供了技术支持。
与该研究相关的一项中国发明专利申请《PLpro蛋白抑制剂在治疗或预防新型冠状病毒感染的药物中的应用》已经于2020年12月10日进入实质审查阶段,申请号:202010511707.4。申请人为北京大学深圳研究生院和深圳市第三人民医院。
文章链接:
https://www.nature.com/articles/s41467-020-20718-8