近日,北京大学深圳研究生院叶涛课题组完成了incarnatapeptins A和B的首次全合成。作者以最长线性步骤12步反应,分别以26.5%与19.7%的收率完成了incarnatapeptins A和B的全合成,同时确定了incarnatapeptin B中苏氨酸残基的绝对构型。该合成路线主要特点:1)光催化的脱羧共轭加成反应合成复杂缩酮侧链5;2)碳酸银介导的含哌嗪酸片段酰胺键的连接;3)作者观察并证实了含哌嗪酸线性多肽片段在室温下的阻转异构现象(图1)。
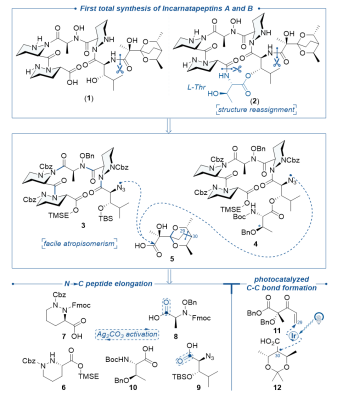
图1 incarnatapeptins A和B的逆合成分析
哌嗪酸是一种结构独特的非天然氨基酸,由于哌嗪酸的刚性结构,使得许多含哌嗪酸的天然产物具有良好的抗癌或抗菌活性。2020年,Andersen小组从猪链霉菌(Streptomyces incarnatus)培养液NRRL 8089分离得到海洋天然产物incarnatapeptins A和B(图1)。从结构上看,二者均具有含哌嗪酸的多肽片段与聚酮衍生的3,5-二甲基-2,6-二氧双环[2.2.2]辛烷片段。然而环酯肽incarnatapeptin B的分离样品仅有0.3 mg,该小组未能确定分子中苏氨酸残基的绝对构型。由于该家族分子中存在复杂的缩酮侧链和三个哌嗪酸残基,因此incarnatapeptins A和B在合成上有很大的挑战。
为了完成全合成工作,作者首先进行复杂聚酮片段5的合成,此片段的关键在于手性叔醇以及缩酮结构的构建。作者对反应体系中碱、溶剂和添加剂等条件进行筛选,采用光催化脱羧的Michael加成反应实现了烯酮片段11和手性甲基片段12 C-C键的高效连接得到缩酮前体20,随后经过酸化/氢化得到聚酮片段5(图2a)。
在成功构建侧链片段后,接下来的挑战是含哌嗪酸多肽片段的构建,其中哌嗪酸α-氨基酰胺键的构建比一般天然胺基酸酰胺键的构建困难。当哌嗪酸β-氨基有吸电子基团保护(Boc、Cbz等)时,由于位阻和立体电子效应的影响使得哌嗪酸α-氨基的活性极大程度地下降。根据现有的文献报道,此位点进行酰胺缩合时不仅需要酰氯底物,而且需要额外的活化试剂,比如剧毒的AgCN。考虑到文献报道的活化试剂仍有较大的局限性,作者筛选出了便宜、安全且环境友善的碳酸银,并研究银盐活化的机理,成功实现了哌嗪酸α-氨基酰胺键的构建(图2b)。

图2光催化脱羧Michael加成和活化试剂Ag2CO3实现N2哌嗪酸酰胺缩合
在完成手性非天然产物衍生物6、7、8、9、10大量制备后,作者基于上述筛选出的碳酸银活化酰氯,实现含哌嗪酸复杂片段的酰胺键构建,最终作者成功以高效高产率的方式,完成了incarnatapeptins A和B的首次全合成(图3)。

图3 incarnatapeptins A和B的全合成
在合成过程中作者首次发现并通过TLC等实验证实了某些含有哌嗪酸片段的线性多肽存在阻转异构且在室温下可以相互转变的现象(化合物32、30、S20和3)。由于此类化合物可以在TLC水平相互转变,对合成化学家会存在极大的误导。此现象的发现与证实有望对含哌嗪酸天然产物的合成提供经验指导(图4)。
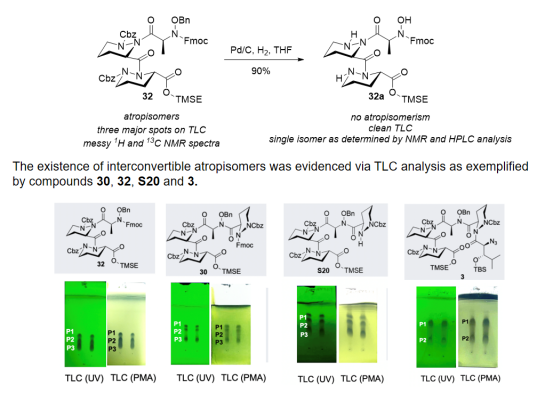
图4线性多肽阻转异构现象
北京大学深圳研究生院博士研究生韩飞朋与李倢为该论文的共同第一作者,该研究得到了国家自然科学基金和深圳市高校可持续发展支持基金的支持。
原文链接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202317636