北京大学深圳研究生院化学基因组学重点实验室、化学生物学与生物技术学院陈语谦团队,在数字医学领域的顶级期刊npj Digital Medicine(IF=12.4,中科院一区Top)发表了题为Dual modality feature fused neural network integrating binding site information for drug target affinity prediction的研究论文。研究人员在药物靶点亲和力预测领域取得重大突破。该团队开发了一种创新的双模态神经网络模型,能够准确预测药物与靶点蛋白之间的结合亲和力,这一成果有望显著加速药物研发进程。
准确预测药物与靶点之间的结合亲和力是药物研发中的关键步骤,但传统的实验方法耗时长且成本高昂。尽管人工智能技术在该领域取得了显著进展,但现有的计算方法往往难以同时利用药物和蛋白质的序列与结构信息,且在处理药物分子与蛋白质的尺度差异时存在挑战。针对这些关键难题,作者设计了DMFF-DTA,这是一种基于双模态神经网络的药物靶点亲和力预测模型。DMFF-DTA创新性地整合了序列模态特征提取模块和图模态特征提取模块,通过序列和图结构两个维度对药物和靶点进行建模。此外,为了解决药物和蛋白质图之间的尺寸不平衡问题,模型引入了基于AlphaFold2的结合位点接触图构建方法。
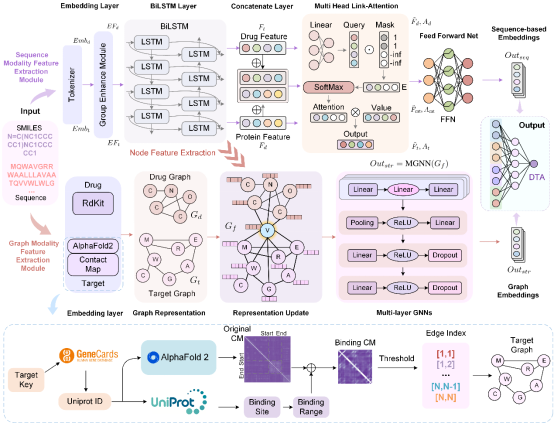
DMFF模型的框架和工作流程
这一模型能够有效整合药物和靶点的多维度信息,显著提升了预测准确性。在两个标准数据集(Davis和KIBA)上的实验结果表明,DMFF-DTA模型的预测性能显著优于现有方法。在Davis数据集上,模型将均方误差(MSE)降低了3.6%,一致性指数(CI)提高了0.3%。在KIBA数据集上,模型同样实现了3.4%的MSE降低和0.5%的CI提升。这些改进在统计上均具有显著性(P < 0.05)。
通过详细的可解释性分析,研究团队证实了模型能够准确识别药物-靶点相互作用中的关键区域。统计分析显示,在结合位点和结合范围区域的注意力值显著高于其他区域(t检验,p < 0.05)。案例分析进一步表明,模型特别关注药物分子中的功能团(如O、N、Cl、F原子)以及苯环结构,这与实际的结合模式高度一致。
为了验证模型在实际药物研发中的应用价值,研究团队以胰腺癌为例进行了药物重定位研究。通过系统的分析,包括通路映射和药物理化性质评估,成功识别出诺司卡品等具有潜力的候选药物。分子对接结果进一步验证了预测的可靠性,展示了模型在实际药物开发中的应用前景。
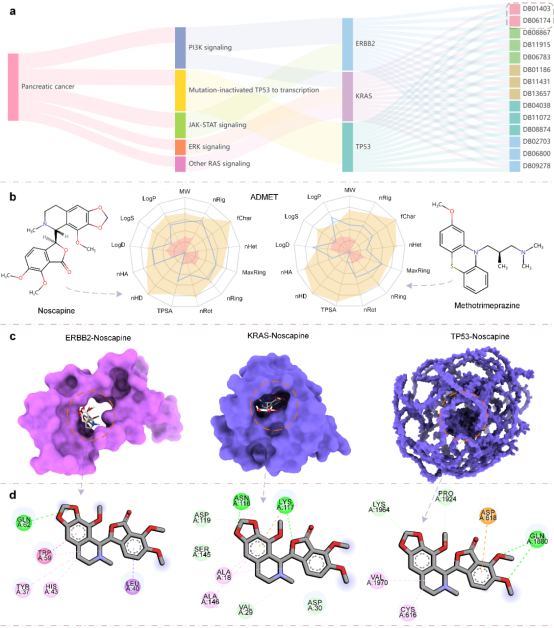
DMFF模型在胰腺癌药物重利用案例分析结果
在这项研究中,作者介绍了DMFF-DTA,一种创新的双模态神经网络模型,能够有效整合药物和靶点的序列与结构信息,实现准确的药物-靶点亲和力预测,以及独特的基于AlphaFold2的结合位点图构建方法,有效解决了药物分子与蛋白质之间的尺度差异问题。总的来说,本论文所提出的DMFF-DTA通过创新的双模态特征融合策略和高效的结合位点建模方法,在预测准确性、计算效率和可解释性等方面都取得了显著进展。此外,其优异的泛化能力和实用的案例验证使其成为药物研发领域的有力工具,为加速药物开发提供了新的解决方案。
相关成果以"Dual modality feature fused neural network integrating binding site information for drug target affinity prediction"为题,发表于《npj数字医学》(npj Digital Medicine)杂志。北京大学深圳研究生院化学基因组学重点实验室、化学生物学与生物技术学院陈语谦为通讯作者,研究生何昊淮为第一作者。
参考资料
He, H., Chen, G., Tang, Z. et al. Dual modality feature fused neural network integrating binding site information for drug target affinity prediction. npj Digit. Med. 8, 67 (2025).