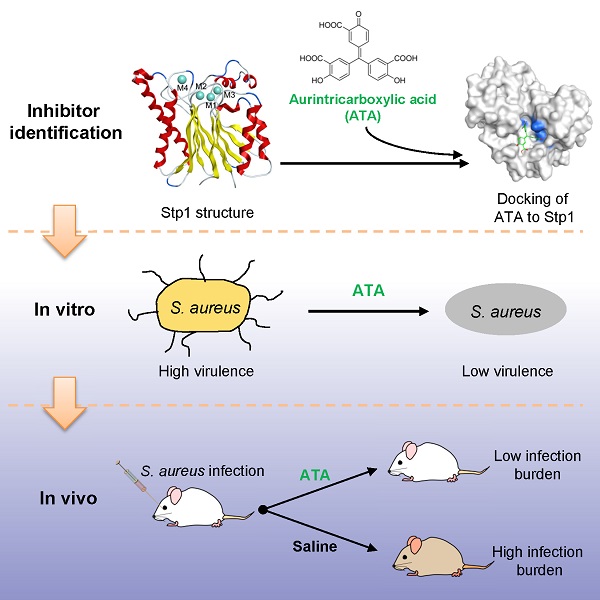
北京大学深圳研究生院李子刚课题组最近在Cell子刊Cell Chemical Biology上发表题为“Structure-based Identification of a Potent Inhibitor Targeting Stp1-mediated Virulence Regulation in Staphylococcus aureus”的论文,首次报道金黄色葡萄球菌(金葡菌)丝氨酸/苏氨酸磷酸酶Stp1的晶体结构,并发现靶向Stp1的抑制剂,揭示Stp1是一个潜在的抗金葡菌感染新靶点。
抗生素滥用给予细菌强大的选择压力,催生耐药菌的出现。其中,“超级细菌”耐甲氧西林金葡菌呈现多重耐药已成为临床治疗的难点,这迫切需要我们转变思路发展新型抗细菌感染药物。在金葡菌致病过程中,多种毒力因子充当“武装”在“攻城略地”中起着关键作用。理论上靶向生长非必需的毒力调控因子,能在降低感染的同时减少选择压力,降低耐药菌的出现。Stp1是金葡菌的一个重要的毒力调控因子,通过抑制Stp1来解除其“武装”,有望降低感染且避免耐药菌出现。
在前期工作中,研究人员报道了Stp1的第一个抑制剂5,5'-亚甲基二水杨酸 (MDSA) (ChemBioChem, 2015,16:1035-40)。在本项研究中,研究人员首次解析了Stp1的晶体结构,并发现第四个金属离子是Stp1活性所必需的,这在同源家族中从未报道过。随后,结合结构信息,研究人员通过优化筛选鉴定到一个抑制活性和选择性更好的抑制剂,金精三羧酸(ATA)。体外实验表明ATA能通过靶向Stp1来抑制金葡菌分泌相关毒力因子。ATA不抑制金葡菌的体外生长,却能明显抑制其对小鼠的感染。该研究揭示了Stp1是一个可行的抗金葡菌感染靶点,为抗生素替代物,特别是抗毒力药物的研发提供一条新路径。
该工作由李子刚副教授指导,博士研究生郑维豪和蔡晓丹(共同第一作者)和课题组成员合作完成。南方科技大学汪涛副教授帮助解析了Stp1晶体结构,为本文的共同通讯作者。该工作得到了国家自然科学基金,深圳市创新基金以及深圳市孔雀计划项目的支持。